Vedi traduzione automatica
Questa è una traduzione automatica. Per vedere il testo originale in inglese cliccare qui
#News
Saggio di guarigione delle ferite - cosa, perché e come
BONUS: Scarica il pacchetto Scratch Assay Bundle
Test in vitro di guarigione delle ferite, noto anche come test dei graffi
Il test di guarigione delle ferite, noto anche come test del graffio, è una consolidata tecnica bidimensionale (2D) che può essere utilizzata per indagare la migrazione collettiva e la guarigione delle ferite in vitro [1], [2]. Questo metodo è stato uno dei primi ad essere sviluppato per lo studio della migrazione cellulare e misura la velocità con cui le cellule, in un monostrato cellulare, migrano per riempire un vuoto senza cellule [1], [3]. I saggi tridimensionali (3D) di guarigione delle ferite esulano dall'ambito di questo articolo e sono brevemente trattati da Stamm et al. 2016 [2].
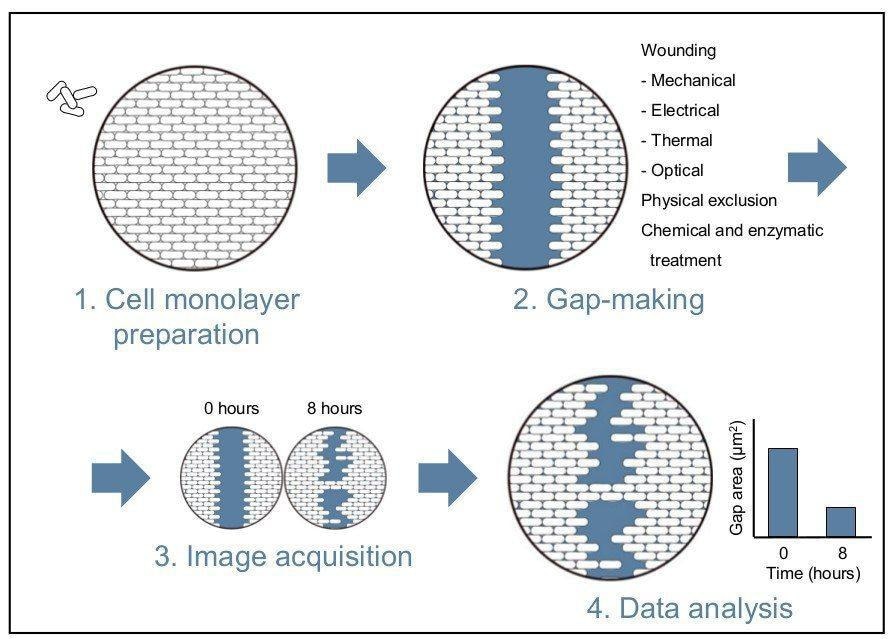
Il test di guarigione delle ferite è un metodo semplice ed economico. Anche se questo test non ricapitola le condizioni esatte di una ferita, può essere applicato con successo per modellare e indagare il movimento delle cellule in un ambiente controllato in vitro. La tecnica riproduce la ferita creando una lacuna in un monostrato cellulare confluente e consiste in quattro fasi principali che verranno elaborate in seguito (vedi figura 1 per una panoramica)[1].
Protocollo del test di guarigione della ferita
Preparazione della cultura
Il primo passo del saggio è la coltura di un monostrato cellulare confluente. Questo monostrato rappresenta le condizioni in vivo del tessuto prima della ferita come, ad esempio, un epitelio intatto. Il più delle volte, le cellule epiteliali ed endoteliali sono utilizzati per produrre il monostrato, e in particolare, i tipi di cellule in grado di migrazione foglio [4]. Gli studi hanno anche esaminato la migrazione delle cellule della muscolatura liscia vascolare [5], [6].
A seconda del tipo di cellula utilizzata nel saggio, la proliferazione cellulare può essere un fattore di confusione. La proliferazione cellulare può competere con la migrazione cellulare per colmare il vuoto che si è creato durante il saggio. Se questo si verifica, il mezzo cellulare può essere ottimizzato per ridurre la proliferazione cellulare. Diminuire la concentrazione di siero (fame nel siero) è il cambiamento più comune. Gli inibitori della proliferazione, come la mitomicina C, possono anche essere aggiunti al terreno di coltura. Un'attenta ottimizzazione è necessaria in quanto qualsiasi cambiamento del mezzo può portare a tempi imprevedibili e ad effetti dipendenti dal tipo di cellula che possono interferire nel saggio [1].
Gratta e Vinci
Dopo che le cellule sono diventate confluenti, il passo successivo è quello di fare un gap senza cellule nel monostrato. Il metodo più frequentemente utilizzato è quello di avvolgere il monostrato con un graffio meccanico (ferita da graffio) o stampaggio. Alternative ai danni meccanici possono includere ferite termiche, elettriche e ottiche [2], [7]. Nei saggi microfluidici di guarigione delle ferite, sono stati utilizzati trattamenti chimici ed enzimatici per eliminare le cellule dai canali dei fluidi [5], [6], [8], [9]. Sono stati descritti anche metodi che evitano del tutto il danno cellulare, come l'esclusione fisica, [4], [10].
La preparazione dei vuoti può essere eseguita manualmente o automatizzata. Gli svantaggi del metodo manuale di ferimento sono la bassa produttività e la variazione da pozzo a pozzo della larghezza della fessura [1], [11]. Questa riproducibilità può essere migliorata con l'uso di strumenti commerciali per la realizzazione di gap uniformi [1]. Le modifiche al test di guarigione delle ferite che fanno uso dell'automazione possono aumentare sia la produttività che migliorare la riproducibilità [2], [7]. Garantire la riproducibilità è importante per la seguente fase di acquisizione dati.
Acquisizione dati - immagini graffiate per time-lapse
Con un gap privo di cellule preparato, la microscopia ottica può essere utilizzata per osservare le cellule che migrano nella zona della ferita. La migrazione delle cellule è meglio osservata utilizzando l'imaging a contrasto di fase piuttosto che la fluorescenza, e l'area della ferita nel campo visivo dovrebbe essere massimizzata utilizzando l'obiettivo [12] [13].
Una volta che il microscopio è impostato una serie di immagini time-lapse (metodo dell'istantanea) possono essere acquisite mentre le cellule migrano nella fessura senza cellule [1]. Questi punti di tempo devono essere raccolti entro 24 ore dall'inizio dell'esperimento per minimizzare gli effetti confondenti della replicazione cellulare sulla chiusura del gap. Le immagini della migrazione possono poi essere utilizzate per raccogliere misurazioni o per ottenere un punteggio visivo [4]. Misurazioni accurate possono essere acquisite manualmente utilizzando una fotocamera digitale montata sul microscopio; tuttavia, questo processo richiede molto tempo, e mantenere lo stesso campo visivo lungo ogni gap può essere difficile [4].
Gli svantaggi sperimentati con l'acquisizione manuale possono essere ampiamente superati utilizzando l'automazione che consente l'imaging delle cellule in tempo reale. Gli aspetti dell'acquisizione che possono essere automatizzati includono: acquisizione di immagini, visita di punti e controllo ambientale [2], [4]. L'automazione ha anche una maggiore funzionalità, ad esempio può essere usata per determinare gli endpoint sperimentali e generare misurazioni cinetiche, funzionali e quantitative delle cellule viventi (vedi figura 2) [1].
I sistemi di imaging a pozzetto intero possono essere applicati al test di guarigione delle ferite. Per i ricercatori interessati a tale funzionalità si veda la pagina di atterraggio di CytomSMART Omni. Questo sistema di imaging a cellule vive opera dall'interno di incubatori di colture cellulari ed è completamente automatizzato, per creare facilmente video time-lapse di gap-closure.
Analisi dei dati - chiusura a graffio
Una volta acquisite le immagini della chiusura del gap, è possibile utilizzare diversi metodi di analisi per quantificare il tasso di migrazione delle cellule. Il primo metodo misura la variazione della larghezza della ferita (nanometri) nel tempo. Questa larghezza è la distanza media tra i due margini della ferita. Il secondo metodo calcola la variazione dell'area della ferita nel tempo come percentuale della chiusura della ferita. Questi due metodi possono richiedere molto tempo se eseguiti manualmente. Il metodo finale misura la densità relativa della ferita nel tempo espressa in percentuale e viene applicato più spesso nei software di imaging a cellule vive [1], [12]. Questo metodo calcola il rapporto tra l'area occupata nella fessura e l'area totale della fessura iniziale. Il metodo della densità relativa della ferita può essere ulteriormente affinato per tener conto della proliferazione cellulare o degli effetti farmacologici. Questo può essere ottenuto contando le cellule nelle sottoregioni che si trovano all'interno e all'esterno dell'area della ferita per determinare la densità relativa delle cellule [12]. Il conteggio totale delle cellule all'interno dell'area della ferita può anche essere utilizzato per valutare la migrazione cellulare e la guarigione della ferita [2].
Oltre a misurare i cambiamenti nell'area della ferita, il test di guarigione della ferita può essere applicato anche per tracciare il movimento delle singole cellule sul bordo anteriore della ferita. Questo permette ai ricercatori di comprendere il ruolo dei geni nella regolazione della migrazione delle cellule [3].
La maggior parte dei test di guarigione delle ferite utilizzano ancora in parte l'acquisizione e l'analisi manuale dei dati. L'estrazione manuale dei dati è molto dispendiosa in termini di tempo, soggettiva e soggetta ad errori. Pertanto, l'analisi di grandi serie di dati rimane un collo di bottiglia con molti saggi. Inoltre, la moltitudine di saggi disponibili rende difficile il confronto fra gli esperimenti [2]. Sono stati sviluppati software di analisi automatica dei dati, come TScratch e ImageJ, che possono accelerare significativamente l'analisi e superare i limiti associati alla qualità dell'immagine [14], [15].
Per le linee guida di approfondimento del test di guarigione delle ferite sui parametri per garantire risultati quantitativi e riproducibili, si veda la revisione di Jonkman et al. (2014)[4].
Saggio di migrazione cellulare
Il test di guarigione delle ferite viene utilizzato per indagare la migrazione delle cellule e la guarigione delle ferite. La migrazione cellulare è il movimento delle singole cellule, dei fogli cellulari e dei cluster da un luogo all'altro, e sono stati identificati due tipi principali, ovvero la migrazione monocellulare e la migrazione cellulare collettiva. Quest'ultima è definita da Grada et al. (2016) come il movimento coordinato di un gruppo di cellule che mantiene le loro connessioni intercellulari e la polarità collettiva [1].
La migrazione collettiva può assumere due forme diverse a seconda della matrice extracellulare. La migrazione collettiva tridimensionale avviene su un'impalcatura tissutale, ed è il movimento di cellule organizzate in una rete multicellulare di fili. La migrazione collettiva bidimensionale (2D) (migrazione dei fogli) avviene su una superficie tissutale, ed è il movimento di fogli piani monostrato. La guarigione delle ferite è un esempio di migrazione dei fogli [1].
-----------
Per i ricercatori che cercano di valutare i modelli di migrazione a cella singola consigliamo il CytoSMART Lux2 Duo Kit. Questo sistema di imaging cellulare mini-cellulare funziona dall'interno di incubatori di colture cellulari e consente il confronto tra le colture cellulari.
-----------
Guarigione delle ferite
Durante la guarigione delle ferite si verificano quattro processi, vale a dire emostasi, infiammazione, proliferazione delle migrazioni e rimodellamento della maturazione [1], [2]. In seguito alla lesione e sotto l'influenza dei fattori di crescita e delle citochine, i cheratinociti nella parte posteriore del margine della ferita iniziano a proliferare e a migrare sul letto della ferita. Questo processo comporta la migrazione delle cellule, la proliferazione e la differenziazione [1].
La migrazione è considerata il processo di limitazione del tasso durante la guarigione, e quindi i saggi di migrazione sono una parte fondamentale dell'indagine sulla guarigione delle ferite [2].
Applicazioni del test di guarigione delle ferite
Il test di guarigione delle ferite è un metodo conveniente ed economico per indagare la migrazione collettiva delle cellule in diverse condizioni sperimentali. Poiché la migrazione cellulare collettiva è legata a molti processi fisiologici e patologici legati all'embriogenesi, alla riparazione delle ferite e alle metastasi tumorali, il test di guarigione delle ferite è ampiamente applicabile [4], [8]. Il test può essere utilizzato per indagare gli effetti dell'interazione cellula-matrice e cellula-cellula sulla migrazione cellulare, ed essere combinato con la trasfezione per determinare l'effetto dell'espressione dei geni esogeni sulla migrazione delle singole cellule [1], [3].
Il test è anche scalabile e permette di effettuare uno screening ad alta velocità dei geni coinvolti nella migrazione delle cellule tumorali, nella scoperta di piccole molecole e nella scoperta di farmaci [1], [2], [16]. Di seguito sono presentati alcuni esempi di queste applicazioni.
Un saggio microfluidico di guarigione delle ferite è stato sviluppato da Wei et al. (2015) per studiare la migrazione vascolare delle cellule muscolari lisce. La migrazione di queste cellule dopo una lesione endoteliale è un fattore intrinseco nella progressione dell'aterosclerosi e delle complicazioni associate all'iperplasia intima [6]. Entrambe queste malattie sono una delle principali cause di morbilità e mortalità a livello globale [17]. La comprensione dei processi coinvolti in questa migrazione può fornire potenziali obiettivi di inibizione. Questo test modificato di guarigione delle ferite è una rappresentazione più vicina del microambiente presente nella vascolarizzazione. Nello studio il saggio microfluidico di guarigione delle ferite utilizzando cinque tipi di VSMC [6].
Il test di guarigione delle ferite può essere utilizzato nello studio delle medicazioni. Alves et al. (2020) hanno utilizzato il test per studiare nuove miscele di idrogel come potenziale medicazione della ferita. L'effetto dell'idrogel sulla chiusura della ferita è stato valutato incorporandolo nel mezzo cellulare. Gli autori hanno dimostrato che l'idrogel può essere utilizzato per migliorare il processo di guarigione della ferita promuovendo la migrazione, l'adesione e la proliferazione dei fibroblasti [18].
Gli inibitori dell'invasione cellulare e delle metastasi possono essere efficacemente controllati con il test di guarigione delle ferite. Wang et al. hanno analizzato con successo gli alcaloidi citotossici per la capacità di inibire i processi biologici legati alla migrazione delle cellule e alla dinamica del citoscheletro. Lo studio è stato in grado di identificare alcuni alcaloidi citotossici come agenti antimigranti che potrebbero essere ulteriormente investigati [19].
Autore
Guy Regnard
Ho un background in scienze della vita con un dottorato di ricerca in biologia molecolare e cellulare. Il mio dottorato si è concentrato su un virus animale per comprenderne la genetica e sviluppare un candidato vaccino. Il mio lavoro si è concentrato sullo sviluppo di vaccini di sottounità per fermare i virus che colpiscono la nostra salute e hanno un impatto sulla nostra economia. Questi includono l'HIV, il papillomavirus umano (che causa il cancro al collo dell'utero) e i virus che infettano pecore e suini.
Scoprite tutte le soluzioni di imaging CytoSMART sul sito web ufficiale di CytoSMART
Riferimenti
A. Grada, M. Otero-Vinas, F. Prieto-Castrillo, Z. Obagi, e V. Falanga, "Tecniche di ricerca rese semplici: analisi della migrazione cellulare collettiva usando il test di guarigione delle ferite", J. Invest. Dermatol., vol. 137, n. 2, pp. e11--e16, 2017.
A. Stamm, K. Reimers, S. Strauß, P. Vogt, T. Scheper e I. Pepelanova, "In vitro wound healing assays-state of the art", BioNanoMaterials, vol. 17, n. 1-2, pp. 79-87, 2016.
L. G. Rodriguez, X. Wu, e J.-L. Guan, "Wound-healing assay", in Cell Migration, Springer, 2005, pp. 23-29.
J. E. N. Jonkman et al., "An introduction to the wound healing assay using live-cell microscopy", Cell Adh. Migr., vol. 8, no. 5, pp. 440-451, 2014.
A. D. der Meer, K. Vermeul, A. A. A. Poot, J. Feijen e I. Vermes, "A microfluidic wound-healing assay for quantifying endothelial cell migration", Am. J. Physiol. Circ. Physiol., vol. 298, n. 2, pp. H719--H725, 2010.
Y. Wei et al., "A tubing-free microfluidic wound healing assay che permette la quantificazione della migrazione vascolare delle cellule muscolari lisce", Sci. Rep., vol. 5, p. 14049, 2015.
C. R. Keese, J. Wegener, S. R. Walker e I. Giaever, "Saggio elettrico di guarigione delle ferite per le cellule in vitro", Proc. Natl. Acad. Sci., vol. 101, n. 6, pp. 1554-1559, 2004.
R. Riahi, Y. Yang, D. D. Zhang, e P. K. Wong, "Avanzamenti nei test di guarigione delle ferite per sondare la migrazione cellulare collettiva", J. Lab. Autom., vol. 17, n. 1, pp. 59-65, 2012.
J.-Y. Lin, K.-Y. Lo, e Y.-S. Sun, "A microfluidics-based wound-healing assay per studiare gli effetti delle sollecitazioni di taglio, larghezza della ferita, e le sostanze chimiche sul processo di guarigione delle ferite", Sci. Rep., vol. 9, n. 1, pp. 1-11, 2019.
[10] A. P. Looney e M. Bhattacharya, "Fibroblast Gap-closure Assay-Microscopy-based in vitro Assay Measuring the Migration of Murine Fibroblasts," Bio-protocollo, vol. 9, n. 16, 2019.
S. Martinotti e E. Ranzato, "Scratch Wound Healing Assay", 2019.
[12] S. T. Johnston, E. T. Shah, L. K. Chopin, D. L. S. McElwain e M. J. Simpson, "Estimating cell diffusivity and cell proliferation rate by interpreting IncuCyte ZOOMTM assay data using the Fisher-Kolmogorov model", BMC Syst. Biol., vol. 9, n. 1, pag. 38, 2015.
C. N. Ramirez et al., "Validation of a high-content screening test using whole well imaging of transformed phenotypes," Assay Drug Dev. Technol., vol. 9, no. 3, pp. 247-261, 2011.
T. Gebäck, M. M. P. Schulz, P. Koumoutsakos e M. Detmar, "TScratch: un nuovo e semplice strumento software per l'analisi automatizzata dei saggi di guarigione delle ferite monostrato: Brevi rapporti tecnici", Biotechniques, vol. 46, n. 4, pp. 265-274, 2009.
K. A. Main, C. M. Mikelis, e C. L. Doçi, "In Vitro Wound Healing Assays to Investigate Epidermal Migration", 2019.
[16] J. C. Yarrow, Z. E. Perlman, N. J. Westwood, e T. J. Mitchison, "A high-throughput cell migration assay using scratch wound healing, a comparison of image-based readout methods", BMC Biotechnol., vol. 4, n. 1, p. 21, 2004.
K. Kobiyama, R. Saigusa e K. Ley, "Vaccinazione contro l'aterosclerosi", Curr. Opin. Immunol., vol. 59, pp. 15-24, 2019.
A. Alves et al., "Xanthan Gum--Konjac Glucomannan Blend Hydrogel for Wound Healing," Polymers (Basel), vol. 12, n. 1, p. 99, 2020.
[19] X. Wang, C. C. Decker, L. Zechner, S. Krstin, e M. Wink, "In vitro wound healing of tumor cells: inhibition of cell migration by selected cytotoxic alcaloids", BMC Pharmacol. Toxicol., vol. 20, n. 1, pp. 1-12, 2019.





