Vedi traduzione automatica
Questa è una traduzione automatica. Per vedere il testo originale in inglese cliccare qui
#News
Guida all'apprendimento della fotometria in fibra per principianti
imparare la tecnologia della fotometria a fibre ottiche
Se state iniziando a conoscere la tecnologia della fotometria a fibre ottiche, questo articolo vi sarà molto utile.
La fotometria in fibra è un metodo ottico che si basa sul principio della misurazione della luce emessa da molecole fluorescenti tramite fibre ottiche con conteggio dei fotoni singoli correlati nel tempo (TCSPC). Da questo principio, sappiamo che la realizzazione di questo esperimento richiede strumenti di sonda in grado di esprimere la fluorescenza nel tessuto, nonché una serie di apparecchiature in grado di trasmettere la fluorescenza e rilevarla.
Per prima cosa esaminiamo gli strumenti di fluorescenza. Attualmente gli strumenti di fluorescenza più comunemente utilizzati si dividono in indicatori di calcio, indicatori di neurotrasmettitori, indicatori di tensione e così via. Poiché esistono molti tipi di modelli animali per le applicazioni sperimentali e poiché è necessario studiare regioni cerebrali specifiche o addirittura tipi specifici di cellule, le tecniche di editing genico sono state ampiamente utilizzate per lo sviluppo di sonde.
I comuni indicatori di calcio geneticamente codificati (GECI) sono proteine fluorescenti derivate dalla proteina verde fluorescente (GFP, ecc.) e dalle sue varianti (ad esempio, GFP, YFP, CFP, RFP, ecc.) disposte circolarmente e fuse con la calmodulina (CaM) e il dominio M13 della chinasi della catena leggera della miosina. Quando il Ca2+ è presente, si lega alla CaM, determinando un'interazione tra i domini strutturali M13 e CaM, innescando un riarrangiamento strutturale della cpEGFP, che aumenta il segnale di fluorescenza verde/rosso.
I GECI più utilizzati sono: GCaMP, Pericams, Cameleons, TN-XXL e Twitch, tra i quali GCaMP6 e GCaMP7 sono oggi ampiamente utilizzati negli studi di imaging del calcio in vivo grazie alla loro sensibilità superiore. Di seguito è riportata una sintesi dei tipi di GECI comuni.
Figura 1
GCaMP6 GCaMP6s Alta sensibilità, adatta a segnali a bassa frequenza
GCaMP6m Attività moderata, ampio campo di applicazione
GCaMP6f Dissociazione rapida, adatto per segnali ad alta frequenza
jGCaMP7 jGCaMP7s Altamente sensibile e più veloce di GCaMP6s
jGCaMP7f Risposta Df/F potenziata, adatta per esperimenti su singoli potenziali d'azione o attività di gruppo
jGCaMP7b Elevata luminosità del potenziale di riposo, adatto per neuriti o fibre nervose
jGCaMP7c Alto contrasto, adatto all'imaging ad ampio raggio
jRGECO1a jRGECO1a La lunghezza d'onda di eccitazione è spostata verso il rosso e può essere utilizzata con GCaMP
jRCaMP1 jRCaMP1a
jRCaMP1b
Assone-GCaMP Assone-GCaMP Contrassegnare l'assone
Il principio delle sonde per neurotrasmettitori è simile a quello descritto sopra: la cpEGFP è incorporata in specifici recettori per neurotrasmettitori e il legame dei recettori con i neurotrasmettitori innesca un cambiamento conformazionale dei recettori in un segnale fluorescente; i cambiamenti in tempo reale nella concentrazione dei neurotrasmettitori possono essere osservati con l'aiuto di tecniche di imaging. Le sonde per neurotrasmettitori che sono state sviluppate includono DA (dopamina), Ach (acetilcolina), NE (noradrenalina), 5HT (5-idrossitriptamina), Ado (adenosina), ATP (adenosina trifosfato), CCK (colecistochinina), VIP (peptide intestinale vasoattivo), eCB (endocannabinoide), ecc.
A causa del ciclo relativamente lento di variazione del segnale del calcio e dei neurotrasmettitori, se vogliamo registrare il segnale veloce del potenziale di membrana, dobbiamo utilizzare strumenti pertinenti come gli indicatori di tensione geneticamente codificati (GEVI). Le variazioni del potenziale di membrana sono un segno diretto dei potenziali sinaptici e d'azione. In alcuni casi, il segnale GEVI è più veloce e più informativo delle misurazioni effettuate con GECI.
Dopo aver compreso questi indicatori fluorescenti, dobbiamo avere chiaro come esprimere gli indicatori nell'animale. Questa sonda geneticamente codificata può essere espressa in cellule o nel cervello di topo mediante iniezione virale, trasfezione, incrocio di animali e altri mezzi tecnici. Prendiamo come esempio lo studio dell'iniezione stereotassica del cervello: 1. scegliere lo strumento virale appropriato (contenente le informazioni codificate dall'indicatore) da iniettare in un punto specifico; 2. impiantare una fibra ottica per trasmettere la luce di eccitazione e raccogliere la luce di emissione; 3. attendere 2-3 settimane per l'espressione del virus e quindi testare il segnale di fluorescenza.
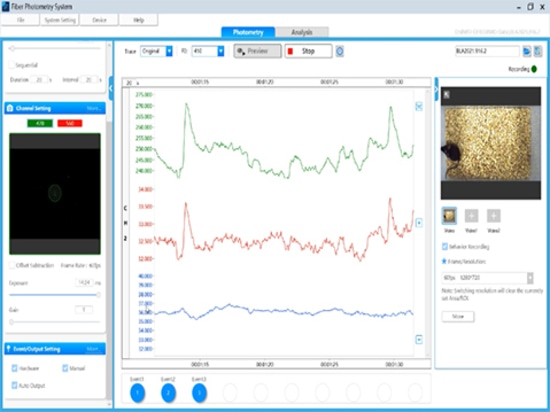
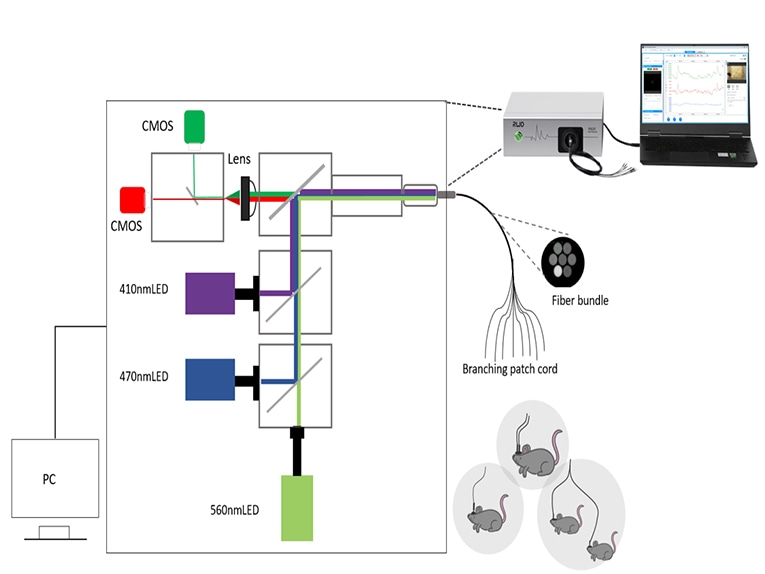
Una volta preparati gli animali, è ora necessario selezionare un sistema adatto per raccogliere e analizzare il segnale di fluorescenza. I componenti di base di un sistema di fotometria a fibre ottiche comprendono sorgenti di luce di eccitazione, filtri, specchi dicroici, rivelatori e accessori per fibre ottiche.
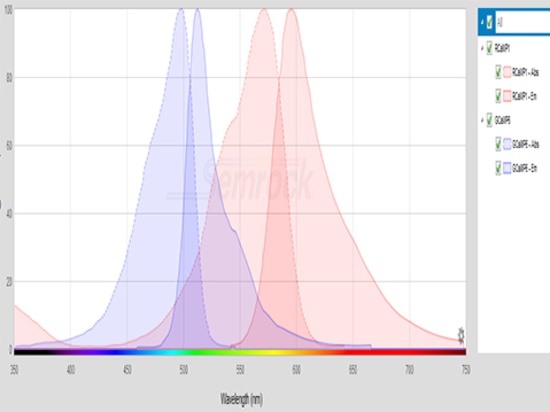
Le lunghezze d'onda di eccitazione del GCaMP sono concentrate tra 450nm-500nm, mentre quelle del RCaMP sono concentrate tra 530nm-580nm. La sorgente luminosa di eccitazione deve essere selezionata in base all'intervallo di lunghezze d'onda di eccitazione dell'indicatore fluorescente. È inoltre necessario scegliere la potenza di eccitazione appropriata, ad esempio 20μW ~ 50μW è più appropriata per le GCaMP eccitate; se la potenza è troppo alta, è facile che il segnale si sbianchi o addirittura si spenga.
Il filtro deve considerare l'intervallo di lunghezze d'onda di emissione della proteina fluorescente. La lunghezza d'onda di emissione della GCaMP è concentrata tra 500nm-550nm, mentre la RCaMP è concentrata tra 570nm-630nm.
Esistono molti tipi di fotorivelatori, come PMT, CCD, CMOS, fotodiodi, ecc. In genere si ritiene che il PMT (tubo fotomoltiplicatore) sia altamente sensibile e adatto alla rilevazione di segnali molto deboli, ma solo per esperimenti a canale singolo; il CCD può essere utilizzato per la registrazione multicanale, ma la velocità di elaborazione delle immagini è lenta; il CMOS ha prestazioni migliori in termini di costi e può essere utilizzato per la registrazione multicanale, mentre la velocità di elaborazione delle immagini è veloce. La registrazione sperimentale multicanale può utilizzare fibre ottiche a più rami, attraverso un sistema in grado di registrare più aree cerebrali o più variazioni del segnale animale.
Gli accessori per le fibre ottiche devono essere scelti con uno strato protettivo nero e un materiale a bassa autofluorescenza per evitare l'interferenza della luce ambientale e dell'autofluorescenza sul segnale. La scelta degli accessori per gli esperimenti di fotometria a fibre ottiche è riportata nel seguente articolo Come scegliere gli accessori per la fotometria a fibre ottiche per una trasmissione del segnale più efficiente? - RWD Life Science (rwdstco.com)
Ci si può chiedere: se inietto due colori di indicatore fluorescente nella stessa area cerebrale, come fa il rilevatore a distinguere i due diversi segnali? Non c'è da preoccuparsi: i due segnali possono essere acquisiti in modo indipendente controllando la luce di eccitazione e il tempo di apertura specifico del rivelatore tramite software, oppure scegliendo di aggiungere altri rivelatori.
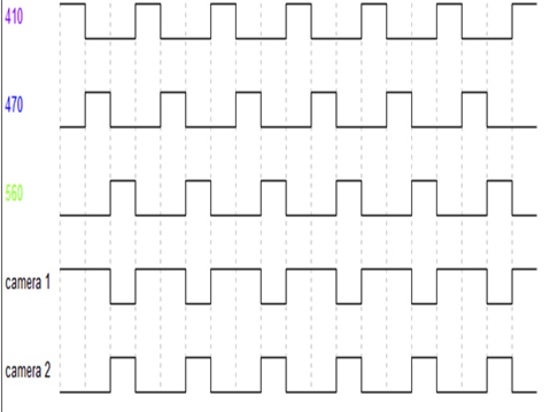
Come si può vedere nella Figura 5, le sorgenti di eccitazione LED 410nm, LED 470nm e LED 560nm si alternano in uscita a un frame rate specifico (che può essere impostato dal software). I due rivelatori, la telecamera1, sincronizzano l'acquisizione del segnale solo all'uscita dei LED 410 e 470nm (corrispondenti alla raccolta del segnale GFP), mentre la telecamera2 sincronizza l'acquisizione del segnale solo all'uscita del LED 560nm (corrispondente alla raccolta del segnale RFP).
Nel sistema di fotometria in fibra RWD, abbiamo utilizzato un design di acquisizione a doppio rivelatore e TDM (Time-division multiplexing) (RWD R820 Tricolor Multichannel Fiber Photometry System - YouTube). Anche se la letteratura ha confermato che il TDM è in grado di evitare l'interferenza reciproca della fluorescenza rossa e verde. Tuttavia, il singolo rivelatore utilizza un filtro a doppia banda (che può essere passato sia per il verde che per il rosso) e c'è la possibilità che la diafonia sia minima. Perché c'è una certa possibilità che il LED a 470 nm ecciti la sonda a fluorescenza rossa, permettendo così di esaltare la fluorescenza rossa e causando una diafonia.
Qual è quindi il ruolo del LED 410nm? Perché è necessario un LED 410 per l'eccitazione simultanea durante la registrazione dei segnali GCaMP? L'intensità della fluorescenza della GCaMP mantiene uno stato costante al variare della concentrazione intracellulare di Ca2+ quando viene eccitata dalla luce alla lunghezza d'onda di 405 - 420 nm. Pertanto, si può ipotizzare in una certa misura che la variazione del segnale corrispondente all'eccitazione a 410 nm rifletta segnali di rumore diversi dalla variazione della concentrazione di Ca2+, come l'autofluorescenza, le variazioni indotte dal movimento, il photobleaching, ecc. Nell'elaborazione dei dati, il segnale di fondo può essere rimosso in modo mirato per ottenere il segnale reale.
La scelta di un sistema appropriato aiuterà il vostro esperimento. Se volete saperne di più sul sistema di fotometria a fibre ottiche, non esitate a contattarci!