#Tendenze
Protocollo di diversi metodi per l'iniezione intracranica
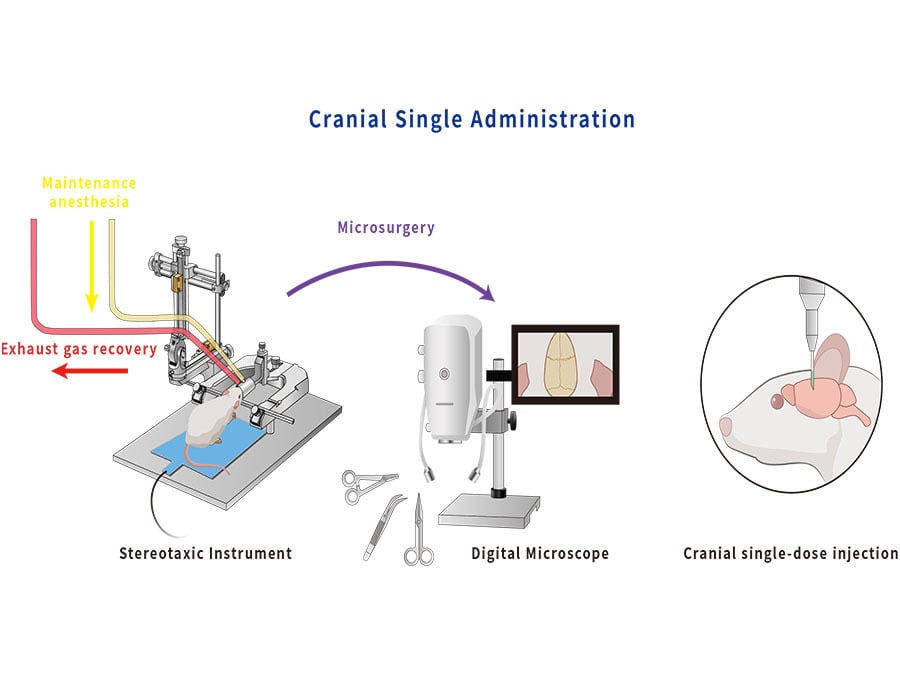
Nel campo della ricerca di base sulla scienza del cervello, l'iniezione stereotassica intracranica è il modo più diretto per ottenere un'iniezione precisa nelle regioni cerebrali bersaglio ed è diventata una parte importante della maggior parte degli
In combinazione con la fibra ottica corrispondente, consente anche la stimolazione ottica o la registrazione del segnale neuronale della regione cerebrale bersaglio durante o dopo l'iniezione. Questo metodo è ampiamente adottato nei modelli animali di malattie neurologiche umane, funzioni cerebrali avanzate, emozioni, cognizione e altri studi correlati.
L'iniezione stereotassica intracranica viene solitamente applicata in somministrazione singola e somministrazioni multiple. Durante l'esperimento, il metodo appropriato può essere selezionato in base alla frequenza di iniezione, al tempo di insorgenza e alla durata dell'azione. In questo documento, elaboreremo questi due metodi in dettaglio, inclusi SOP e suggerimenti.
SOP di Cranial Single Administration
1 Strumenti
Apparecchiatura stereotassica
Macchina per anestesia per animali da laboratorio
Micro pompa a siringa
Estrattore per micropipette
2 Processo e procedura
2.1 Anestesia animale preoperatoria
Accendi la macchina per l'anestesia degli animali. Posizionare il ratto nella scatola di induzione per condurre l'anestesia indotta. Una volta che il ratto è sotto anestesia, estrarlo dalla scatola di induzione e trasferirlo nella maschera per anestesia allo strumento stereotassico con una piastra elettrica. Applicare [XY1] pomata oculare sui loro occhi e preparare la pelle.
2.2 Fissare il cranio
2.2.1 Inserire l'incisivo del topo nel foro della maschera e avvitare delicatamente la clip per il naso.
2.2.2 Spostare la barra dell'orecchio su un lato nella posizione appropriata e avvitarla in posizione. Tenere delicatamente la testa del ratto e allineare la posizione del grande forame occipitale sullo stesso lato della testa con la punta della barra dell'orecchio e spingere lentamente l'altro lato della barra dell'orecchio verso il grande forame occipitale.
2.2.3 Regolare la posizione delle barre auricolari su due lati fino a quando le letture sui lati sinistro e destro sono le stesse.
2.3 Praticare un foro sul cranio
(2.3.1) Fissare il micro trapano sullo strumento stereotassico cerebrale con il supporto del micro trapano e spostare lentamente il micro trapano per toccare il Bregma e impostare lo zero sul display digitale. Muovere lentamente la micropunta fino a toccare la Lambda per registrare il valore di DV. Se il valore assoluto è inferiore a 0,03 mm, il cranio può essere considerato in posizione orizzontale; se maggiore di 0,03 mm, l'altezza dell'adattatore deve essere regolata e le posizioni di Bregma e Lambda devono essere ricalibrate fino a quando il valore assoluto di Lambda DV è inferiore a 0,03 mm.
2.3.2 Spostare il trapano craniale nel punto medio della linea Bregma e Lambda ed espandere i lati sinistro e destro di 0,3 mm. Toccare delicatamente la superficie cranica e registrare i valori DV craniofacciali rispettivamente nei punti sinistro e destro. Se la differenza assoluta è inferiore a 0,03 mm, il cranio può essere considerato in posizione orizzontale; se maggiore di 0,03 mm, l'altezza delle due barre dell'orecchio deve essere regolata fino a quando la differenza assoluta è inferiore a 0,03 mm.
2.3.3 Spostare lentamente il trapano craniale sopra il sito target. Accendere il trapano craniale, quindi abbassare lentamente il trapano cranico osservando la punta del trapano al microscopio fino a raggiungere la dura madre.
2.4 Iniezione intracranica
2.4.1 Utilizzare il capillare di vetro per estrarre il capillare di vetro facendo riferimento ai parametri del programma di iniezione.
2.4.2 Utilizzare un ago di riempimento per riempire il capillare di vetro con olio minerale e picchiettare il capillare di vetro finché le bolle sulla punta non vengono scaricate.
2.4.3 Allentare il mandrino della pompa di iniezione della micropipetta per spingere delicatamente il capillare di vetro verso l'alto, quindi serrare il mandrino.
2.4.4 Impostare i parametri per la velocità di svuotamento e il volume di svuotamento nell'unità di controllo e fare clic per eseguire lo svuotamento.
2.4.5 Immergere la punta del capillare nella soluzione da iniettare. Impostare i parametri per la velocità di riempimento e il volume di riempimento nell'unità di controllo e fare clic per eseguire il riempimento.
2.4.6 Fissare la pompa di iniezione della micropipetta sul braccio operativo. Dopo aver azzerato la punta del capillare, spostare il braccio operativo sopra il sito di destinazione e scendere lentamente nella regione del cervello di destinazione.
2.4.7 Impostare i parametri per la velocità e il volume di iniezione nell'unità di controllo e fare clic per eseguire l'iniezione.
2.4.8 Dopo l'iniezione, spostare lentamente la pompa di iniezione della micropipetta verso l'alto finché la punta del capillare di vetro non viene rimossa dal tessuto cerebrale.
2.5 Sutura
2.5.1 Suturare il cuoio capelluto con sutura sterile, quindi applicare la pomata oculare all'eritromicina per prevenire l'infiammazione della ferita.
2.6 Cure postoperatorie
2.6.1 Tenere il ratto al caldo per 24 ore dopo l'intervento. Iniettare penicillina o altri antibiotici per prevenire l'infezione e fornire al ratto un'adeguata alimentazione e acqua potabile.
3 Suggerimenti
3.1 Dopo che la punta del capillare di vetro raggiunge il sito di destinazione, mantenere il capillare nel sito di iniezione per 1 minuto per bilanciare la pressione dell'aria prima dell'iniezione.
3.2 Per fare in modo che il reagente per iniezione sia completamente assorbito dal tessuto cerebrale, interrompere l'iniezione per 15-20 minuti dopo l'iniezione, quindi estrarre il capillare di vetro.
3.3 Per ridurre la perdita di reagenti sulla traiettoria mobile del capillare di vetro, si consiglia di controllare la velocità di ingresso e uscita dell'ago a 0,01 mm/s.
SOP della somministrazione craniale multipla
1 Strumenti
Apparecchiatura stereotassica
Cannula per la somministrazione di farmaci
Micro pompa a siringa
2 Processo e procedura
2.1 Anestesia animale preoperatoria
2.1.1 Accendere la macchina per anestesia animale. Posizionare il ratto nella scatola di induzione per condurre l'anestesia indotta. Una volta che il ratto è sotto anestesia, estrarlo dalla scatola di induzione e trasferirlo alla maschera di anestesia presso lo strumento stereotassico con un termoforo. Applicare una pomata per gli occhi sugli occhi e radere la pelle sulla testa per la preparazione.
2.2 Fissare il cranio
2.2.1 Inserire l'incisivo del topo nel foro della maschera e avvitare delicatamente la clip per il naso.
2.2.2 Spostare la barra dell'orecchio su un lato nella posizione appropriata e avvitarla in posizione. Tenere delicatamente la testa del ratto e allineare la posizione del grande forame occipitale sullo stesso lato della testa con la punta della barra dell'orecchio e spingere lentamente l'altro lato della barra dell'orecchio verso il grande forame occipitale.
2.2.3 Regolare la posizione delle barre auricolari su due lati fino a quando le letture sui lati sinistro e destro sono le stesse.
2.3 Livellamento del cranio
2.3.1 Fissare il micro trapano sullo strumento stereotassico cerebrale con il supporto del micro trapano e spostare lentamente il micro trapano per toccare il Bregma e impostare lo zero sul display digitale. Muovere lentamente la micropunta fino a toccare la Lambda per registrare il valore di DV. Se il valore assoluto è inferiore a 0,03 mm, il cranio può essere considerato in posizione orizzontale; se maggiore di 0,03 mm, l'altezza dell'adattatore deve essere regolata e le posizioni di Bregma e Lambda devono essere ricalibrate fino a quando il valore assoluto di Lambda DV è inferiore a 0,03 mm.
2.3.2 Spostare il trapano craniale nel punto medio della linea Bregma e Lambda ed espandere i lati sinistro e destro di 0,3 mm. Toccare delicatamente la superficie cranica e registrare i valori DV craniofacciali rispettivamente nei punti sinistro e destro. Se la differenza assoluta è inferiore a 0,03 mm, il cranio può essere considerato in posizione orizzontale; se maggiore di 0,03 mm, l'altezza delle due barre dell'orecchio deve essere regolata fino a quando la differenza assoluta è inferiore a 0,03 mm.
2.4 Praticare un foro sul cranio
2.4.1 Spostare lentamente il trapano craniale sopra il sito target. Accendere il trapano cranico, quindi abbassare lentamente il trapano cranico osservando la punta del trapano al microscopio fino a raggiungere la dura madre cerebralis.
2.4.2 Muovere lentamente il micro trapano e praticare due piccoli fori nella parte anteriore e posteriore della regione cerebrale bersaglio. Inserire delicatamente le viti sterili nel cranio con un cacciavite.
2.5 Impianto della cannula di erogazione del farmaco
2.5.1 Fissare la cannula guida e spostarla lentamente su Bregma e reimpostare il punto zero. Quindi spostare la cannula guida sopra il sito di destinazione e scendere lentamente nell'area di destinazione.
2.5.2 Applicare una quantità appropriata di colla biologica all'apertura del cranio.
2.5.3 Preparare il cemento dentale semi-viscoso da riempire tra la vite e la cannula guida, strato dopo strato, zona per zona.
2.5.4 Avvitare saldamente il cappuccio della cannula guida dopo che il cemento dentale si è completamente solidificato.
2.6 Somministrazione del farmaco con cannula
2.6.1 Utilizzando il tubo PE attraverso la vite di fissaggio e riempire il tubo PE e l'ago di iniezione con olio minerale. Dopo che la siringa è stata riempita con olio minerale, utilizzare una pistola per colla per sigillare la connessione tra il tubo in PE e la siringa e svuotare l'olio minerale nella siringa.
2.6.2 Fissare la siringa nel serbatoio di propulsione della pompa a siringa. La pompa a siringa esegue la procedura di aspirazione e inala il farmaco dalla punta della cannula di iniezione.
2.6.3 Rimuovere la finta cannula. Inserire la cannula di iniezione nella cannula guida
lentamente e serrare la vite di fissaggio.
2.6.4 Lasciare riposare per 1 minuto e consentire agli animali con il tubo di iniezione di adattarsi all'ambiente.
2.6.5 Impostare i parametri di iniezione della pompa di iniezione ed eseguire la procedura di iniezione.
2.6.6 Dopo l'iniezione, interrompere l'iniezione per 1-5 minuti. Quindi rimuovere il tubo di iniezione interno e serrare nuovamente il cappuccio del catetere. L'iniezione è completata.
2.7 Cure postoperatorie
Mantenere il topo caldo per 24 ore dopo l'intervento. Iniettare penicillina o altri antibiotici per prevenire l'infezione e fornire al ratto un'adeguata alimentazione e acqua potabile.
3 Suggerimenti
3.1 Quando si eseguono fori nella posizione in cui sono inserite le viti craniche, è necessario prestare particolare attenzione per non perforare il cranio ed evitare danni al tessuto cerebrale. Inoltre, la posizione di perforazione deve essere mantenuta il più lontano possibile dall'area di impianto della cannula per evitare il blocco della vite craniale.
3.2 Per l'impianto bilaterale, impiantare prima la cannula singola destra per evitare l'ostruzione spaziale.
3.3 Applicare il cemento dentale strato dopo strato per solidificare l'impianto.