#Tendenze
Nuovi obiettivi terapeutici per il carcinoma ovarico epiteliale
Il cancro ovarico rappresenta una minaccia significativa per la salute delle donne.
A livello globale, si classifica come l'ottavo tumore maligno più comune tra le donne ed è il tumore maligno ginecologico più mortale, con il più alto tasso di mortalità tra i tre principali tumori ginecologici (tumori ovarici, cervicali ed endometriali) [1]. In Cina, la situazione per quanto riguarda la prevenzione e la cura del tumore ovarico è altrettanto cupa. Il cancro ovarico è al terzo posto tra i tre principali tumori ginecologici in termini di incidenza ed è in aumento ogni anno. Il tasso di mortalità è anche il più alto tra le neoplasie del tratto riproduttivo femminile [2]. Il cancro ovarico viene spesso definito il "killer silenzioso" perché si trova in profondità all'interno del bacino e i suoi primi sintomi sono spesso nascosti. Al momento della diagnosi, il 70% dei pazienti è già in uno stadio avanzato con diffusione pelvica e addominale (stadio III/IV) [3]. Tra i vari tipi di carcinoma ovarico, il carcinoma epiteliale è il più comune, rappresentando circa l'80% dei tumori ovarici maligni [4]. Secondo la classificazione dell'OMS del 2014, il carcinoma ovarico epiteliale può essere ulteriormente classificato in carcinoma sieroso (70-80%), carcinoma endometrioide (10%), carcinoma a cellule chiare (10%), carcinoma mucinoso (3%) e altri tipi rari (<5%) [5].
Il carcinoma sieroso può essere ulteriormente suddiviso in carcinoma sieroso di alto grado (HGSC) e carcinoma sieroso di basso grado (LGSC). HGSC rappresenta circa il 70% dei casi di carcinoma ovarico epiteliale, mentre LGSC rappresenta il 5% [5]. HGSC è il tipo più comune di cancro ovarico ed è caratterizzato da forte invasività e prognosi infausta. Circa il 70% dei pazienti va incontro a recidiva entro tre anni dal trattamento standard (chirurgia + chemioterapia) e, in definitiva, molti sono incurabili a causa della resistenza ai farmaci acquisita [6]. Negli ultimi anni, la prognosi dell'HGSC nei pazienti con mutazioni BRCA1/2 è migliorata significativamente con l'uso degli inibitori di PARP. Con la continua delucidazione delle caratteristiche molecolari del carcinoma ovarico, il trattamento si è gradualmente spostato verso una terapia di precisione individualizzata e lo sviluppo e l'applicazione di farmaci mirati hanno portato nuove speranze e cambiato l'approccio terapeutico tradizionale.
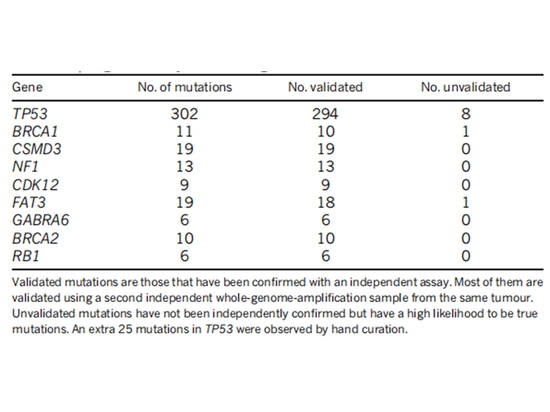
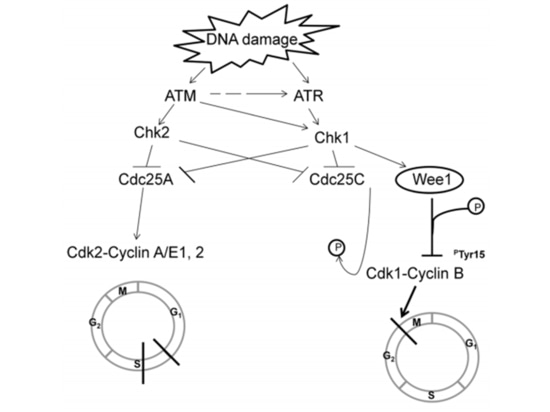
Il team di ricerca del TCGA ha analizzato l'espressione dell'mRNA, l'espressione del microRNA, la metilazione del promotore, il numero di copie del DNA e il sequenziamento del DNA dell'esone dei geni codificanti in 489 casi di adenocarcinoma ovarico sieroso di alto grado. Hanno scoperto che quasi tutte le pazienti con carcinoma ovarico sieroso di alto grado avevano mutazioni TP53 (96%), seguite da mutazioni BRCA1/2 (accumulate nelle mutazioni germinali e somatiche, che rappresentano il 22% dei casi) [7] (Figura 1). Dopo che si verificano le mutazioni TP53, la funzione di checkpoint G1/S delle cellule tumorali viene persa. La chinasi WEE1 può bloccare l'ingresso delle cellule nella mitosi al checkpoint G2/M e riparare il DNA danneggiato per mantenere la stabilità genomica [8] (Figura 2). Se il checkpoint delle cellule G2/M viene alleviato utilizzando un inibitore WEE1, il danno al DNA delle cellule tumorali non può essere riparato, portando alla "letalità sintetica" [8]. Pertanto, gli inibitori WEE1 sono diventati potenziali farmaci terapeutici mirati per il carcinoma ovarico epiteliale mutato TP53. Attualmente, solo adavosertib (AZD1775/MK1775) è in fase di sperimentazione clinica.
Recentemente, i risultati di uno studio clinico di fase II (NCT02151292), pubblicati su The Lancet, hanno attirato l'attenzione globale. Lo studio ha incluso 99 pazienti con carcinoma ovarico sieroso avanzato, refrattario e di alto grado (ovvero pazienti resistenti o refrattarie alla chemioterapia a base di platino).
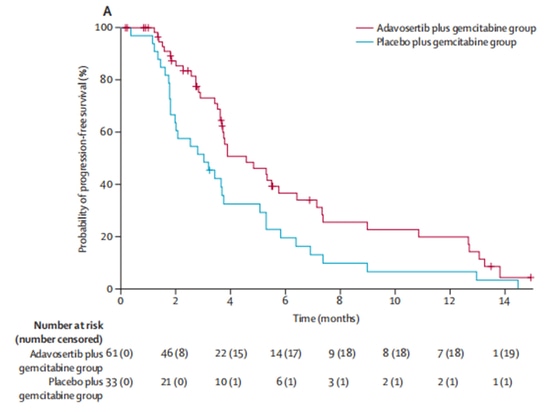
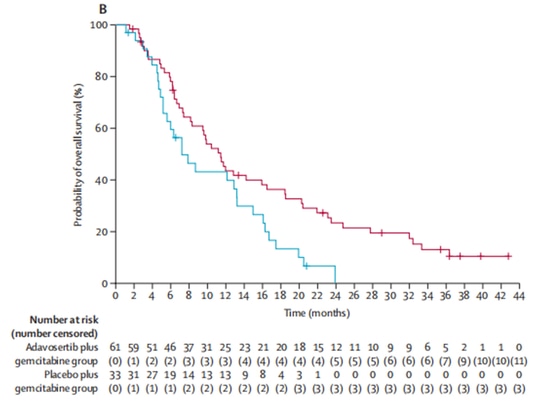
In un rapporto 2:1, il gruppo sperimentale (n=65) ha ricevuto il farmaco sperimentale Wee1 inibitore adavosertib in combinazione con il trattamento con gemcitabina, mentre il gruppo di controllo (n=34) ha ricevuto solo gemcitabina. Dopo l'arruolamento, 5 pazienti hanno abbandonato la sperimentazione clinica per altri motivi e non hanno ricevuto il trattamento. Dei restanti 94 pazienti che hanno ricevuto il trattamento, i tassi di risposta obiettiva sono stati del 23% nel gruppo sperimentale e del 6% nel gruppo di controllo, indicando un miglioramento significativo dei tassi di risposta obiettiva con adavosertib. In termini di sopravvivenza, adavosertib ha anche prolungato significativamente la sopravvivenza mediana libera da progressione (mPFS) da 3,0 mesi a 4,6 mesi, con una riduzione del 45% del rischio di progressione della malattia. La sopravvivenza globale mediana (mOS) è aumentata da 7,2 mesi a 11,4 mesi, con un'estensione media di 4,2 mesi [9] (Figura 3, Figura 4). Lo studio dimostra i benefici clinici dell'inibitore Wee1 in combinazione con la chemioterapia.
Inoltre, uno studio randomizzato in doppio cieco di fase II (NCT01357161) ha dimostrato che adavosertib può potenziare l'efficacia terapeutica del carcinoma ovarico platino-sensibile con mutazione p53 quando combinato con chemioterapia con carboplatino/paclitaxel, migliorando la sopravvivenza libera da progressione (PFS) (7,9 mesi contro 7,3 mesi). Adavosertib è stato osservato per avere benefici clinici moderati [10]. Un altro studio clinico di fase II (NCT01164995) ha indicato che adavosertib migliora l'efficacia del carboplatino nel carcinoma ovarico mutante p53, con un tasso di risposta globale del 43%, ma alla fine si sviluppa resistenza [11]. Uno studio clinico di fase II (NCT02272790) ha mostrato i benefici clinici di adavosertib in combinazione con la terapia con carboplatino; tuttavia, questo trattamento combinato ha causato più frequentemente tossicità ematologica rispetto alla monoterapia con carboplatino [12]. Pertanto, sono necessarie ricerche future per ottimizzare il dosaggio e il regime del trattamento per la combinazione di adavosertib e carboplatino.
Gli inibitori di PARP basati sul principio della "letalità sintetica" hanno dimostrato una significativa efficacia nel trattamento del carcinoma ovarico. Allo stesso modo, gli inibitori WEE1 basati sullo stesso principio sono diventati un'opzione interessante per il carcinoma ovarico epiteliale e hanno mostrato una certa efficacia in altri tumori solidi come il carcinoma endometriale, il carcinoma a cellule squamose della testa e del collo, il carcinoma polmonare a piccole cellule e il carcinoma pancreatico. Anche il meccanismo di sensibilità agli inibitori WEE1 nel carcinoma ovarico viene continuamente studiato. La ricerca ha indicato che lo stato di attivazione di mTOR influisce in modo significativo sulla sensibilità delle cellule tumorali all'inibizione di WEE1. È stato anche riportato che il cancro con difetti H3K36me3 è altamente sensibile all'inibizione di WEE1. Un team guidato da Pan Chaoyun, Yao Shuzhong e Wang Wei della Sun Yat-sen University in Cina ha scoperto che il gene ODF2L è un fattore chiave che determina la sensibilità delle cellule del tumore ovarico epiteliale all'inibizione mirata a WEE1. La combinazione di targeting ODF2L e WEE1 mostra letalità sintetica [13].
La proteina mutante p53 manca di tasche adatte per il legame dei composti a causa della sua superficie liscia, ponendo una sfida significativa nello sviluppo di farmaci. Questa caratteristica ha reso TP53 uno dei tre principali bersagli "non controllabili", insieme a RAS e MYC. Tuttavia, attualmente, ci sono due farmaci sul mercato che prendono di mira la RAS, il che mette in discussione la nozione della sua natura "non controllabile". C'è speranza che il prossimo farmaco basato sul principio della letalità sintetica possa essere approvato e reso disponibile a beneficio di più pazienti.
Riferimenti:
[1] CA Cancro J Clin, 2021.
[2] Giornale del National Cancer Center, 2022, 2(1).
[3] NCCN Cancro ovarico 2023 V1.
[4] Linee guida per la diagnosi e il trattamento del cancro ovarico (edizione 2022).
[5] Libro bianco sullo stato di diagnosi e trattamento del cancro ovarico in Cina (edizione 2022).
[6] Progressi nell'applicazione della medicina di precisione nell'adenocarcinoma sieroso di alto grado dell'ovaio. Fudan Journal of Medical Sciences (edizione medica), 1-10.
[7] Natura, 2011, 474(7353): 609-615.
[8] Ciclo cellulare, 2013, 12(19): 3159-3164.
[9] Lancetta, 2021 gennaio 23; 397(10271): 281-292.
[10] Ricerca clinica sul cancro, 2020, 26(18): 4767-4776.
[11] Journal of Clinical Oncology, 2016, 34(36): 4354-4361.
[12] Journal of Clinical Oncology, 2019, 37(15): S5513 [2021-10-24].
[13] Giornale di ricerca clinica, 2023; 133(2): e161544.