#News
Interpretazione degli endpoint di efficacia della ricerca clinica dei farmaci antineoplastici
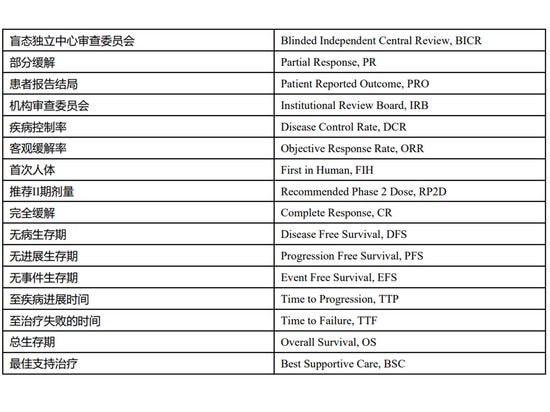
Gli endpoint di efficacia più comunemente utilizzati negli studi clinici sui farmaci antineoplastici includono la sopravvivenza globale (OS), il tasso di risposta obiettiva (ORR), la sopravvivenza libera da progressione (PFS) e l'esito riportato dal
1. Sopravvivenza globale (OS)
La sopravvivenza globale è stata definita come il tempo dalla randomizzazione (o dall'inizio del trattamento negli studi a braccio singolo) alla morte per qualsiasi causa. L'OS è relativamente oggettiva e misurabile con precisione ed è l'endpoint più affidabile per misurare il beneficio clinico dei farmaci antitumorali in studi clinici controllati randomizzati.
Vantaggi: è ampiamente utilizzato e riconosciuto endpoint di beneficio clinico, basato su oggettivi e quantitativi, accurati e facili da misurare e valutare.
Svantaggi: la sopravvivenza a 5 anni viene spesso utilizzata negli studi clinici, che spesso richiedono campioni di grandi dimensioni e un follow-up più lungo. I risultati dello studio possono essere influenzati dal crossover e dal successivo trattamento e anche l'inclusione di decessi non tumorali nei risultati dello studio influirà sull'accuratezza dei risultati.
2. Tasso di risposta obiettiva (ORR)
Per molti tipi di tumore, la valutazione della malattia può essere eseguita direttamente utilizzando l'imaging del tumore e le strategie di trattamento per i soggetti sono spesso basate su misurazioni del tumore e sintomi clinici. Il tasso di risposta obiettiva si riferisce alla percentuale di pazienti il cui volume tumorale si riduce a un valore predeterminato e può mantenere il limite di tempo minimo secondo i criteri di valutazione della risposta riconosciuti (come i tumori solidi RECIST versione 1.1). È l'endpoint più comune basato sulla misurazione del tumore. La risposta dei tumori solidi può essere risposta completa (CR) o risposta parziale (PR), e ci sono alcuni altri criteri di valutazione per la valutazione dei tumori non solidi. L'uso dell'ORR da solo potrebbe non essere in grado di descrivere adeguatamente l'attività antitumorale del farmaco sperimentale [2], quindi è necessario analizzare in modo descrittivo la durata della risposta (ovvero il tempo dalla risposta iniziale del tumore alla progressione della malattia o alla morte per qualsiasi causa , a seconda dell'evento che si verifica per primo) e il tempo di remissione. Per i farmaci che avvantaggiano clinicamente i pazienti stabilizzando la condizione della malattia, è possibile analizzare anche il tasso di controllo della malattia (DCR). Questo indicatore non considera solo i casi di remissione della malattia, ma include anche i casi in cui la malattia mantiene uno stato stabile per un certo periodo di tempo.
Vantaggi: di solito richiede una dimensione del campione più piccola e un tempo di follow-up più breve. L'effetto curativo è attribuito al farmaco e l'esclusione del decorso naturale della malattia è solitamente basata su una valutazione obiettiva e quantitativa, che è più adatta per le prove di popolazione di arricchimento.
Svantaggi: il più grande svantaggio dell'ORR è che l'efficacia dell'ORR potrebbe non essere convertita in benefici di sopravvivenza e durante la valutazione dell'ORR sono necessarie frequenti valutazioni di imaging e l'ORR non è una misura diretta del beneficio clinico dei farmaci. Inoltre, l'uso dell'ORR da solo potrebbe non descrivere completamente l'attività antitumorale del farmaco sperimentale, quindi è necessario analizzare in modo descrittivo la durata della risposta (ovvero il tempo dalla remissione iniziale del tumore alla progressione della malattia o alla morte per qualsiasi causa, a seconda di quale si verifichi prima ) e al tempo di risposta.
3. Sopravvivenza libera da progressione (PFS)
La sopravvivenza libera da progressione è stata definita come il tempo dalla randomizzazione (o dall'inizio del trattamento negli studi a braccio singolo) alla progressione del tumore o alla morte per qualsiasi causa, a seconda di quale si sia verificata per prima. Gli endpoint simili alla PFS includono anche la sopravvivenza libera da malattia (DFS), che si riferisce al tempo dall'inizio della randomizzazione (o dall'inizio del trattamento in uno studio a braccio singolo) alla recidiva della malattia o alla morte per qualsiasi causa (qualunque si verifichi per prima) standard ), ed è principalmente utilizzato per valutare la terapia adiuvante dopo il trattamento chirurgico o la radioterapia. La sopravvivenza libera da eventi (EFS) è definita come il tempo dall'inizio della randomizzazione (o dall'inizio del trattamento in uno studio a braccio singolo) alla prima occorrenza di uno qualsiasi dei seguenti eventi: progressione della malattia dopo l'intervento chirurgico, recidiva locale o a distanza, qualsiasi La causa della morte, ecc., è principalmente utilizzata per valutare la terapia neoadiuvante prima del trattamento chirurgico o della radioterapia.
Vantaggi: di solito richiede una dimensione del campione più piccola e un follow-up più breve rispetto all'OS. Gli studi sono generalmente basati su valutazioni oggettive e quantitative, che non sono influenzate dal crossover e dal successivo trattamento e hanno una maggiore affidabilità.
Svantaggi: la PFS è altamente correlata con l'OS, ma ancora una volta potrebbe non tradursi in un beneficio in termini di sopravvivenza. La valutazione della PFS richiede frequenti valutazioni di imaging, con possibili errori di valutazione. Ancora più importante, i risultati della PFS saranno influenzati dall'intervallo di valutazione e anche le regole di definizione e censura della PFS potrebbero essere diverse tra le diverse prove, quindi deve essere chiaramente definita in anticipo.
4. Esito riferito dal paziente (PRO)
Gli esiti riportati dai pazienti sono segnalazioni direttamente dai pazienti sui loro sintomi, sulla qualità della vita correlata alla salute, sull'aderenza al trattamento e sulla soddisfazione per il trattamento. Sebbene sia sempre più comune raccogliere dati PRO negli studi clinici sui farmaci antitumorali, ci sono ancora molti problemi nella valutazione di tali indicatori di misurazione, come l'affidabilità, la validità e la reattività delle scale utilizzate. Inoltre, anche gli indicatori di misurazione PRO [3] sono suscettibili di dati mancanti e dovrebbero essere utilizzati metodi appropriati per gestire i dati mancanti. Per comprendere meglio la rilevanza dei risultati della sperimentazione, si raccomanda di esplorare il PRO in relazione ad altri endpoint di efficacia.
Riferimenti
[1] "Linee guida per il disegno statistico delle sperimentazioni cliniche di farmaci antineoplastici (trial)" Edizione 2020
[2] Ricerca clinica sul cancro, 2005, 11(21): 7872-7878.
[3]ICH. E9 (R1) Addendum sulle stime e l'analisi di sensibilità nelle sperimentazioni cliniche alla linea guida sui principi statistici per le sperimentazioni cliniche. 2019