Vedi traduzione automatica
Questa è una traduzione automatica. Per vedere il testo originale in inglese cliccare qui
#News
Come potente strumento per il monitoraggio dei tumori, quali sono gli scenari di applicazione della MRD nella promozione clinica?
Come potente strumento per il monitoraggio dei tumori, quali sono gli scenari di applicazione della MRD nella promozione clinica?
La MRD, dalla sua applicazione matura nel campo delle neoplasie ematologiche alla sua implementazione nella pratica clinica dei tumori solidi, sta gradualmente spostando il suo valore dalla valutazione della prognosi al potenziale predittivo, che abbraccia tutte le fasi dello sviluppo tumorale. Con l'avvio di vari studi clinici interventistici, in futuro la diagnosi e il trattamento precisi basati sui risultati della MRD potrebbero potenzialmente ridisegnare il panorama della terapia oncologica, con grande beneficio per la sopravvivenza dei pazienti. In questo numero, esploreremo vari aspetti della MRD attraverso un formato di domande e risposte per fornire approfondimenti completi.
Conoscenze di base
1. Che cos'è la MRD?
La MRD è descritta in vari modi: Malattia residua minima, malattia residua misurabile e malattia residua molecolare. Il concetto, originariamente applicato ai tumori maligni ematologici, si è gradualmente esteso ai tumori solidi. Si riferisce principalmente alle anomalie molecolari derivate dal cancro che non possono essere rilevate con i tradizionali metodi di imaging o di laboratorio dopo il trattamento, ma che vengono scoperte attraverso le biopsie liquide. Queste anomalie servono come biomarcatori che indicano la presenza di cellule tumorali residue nell'organismo dopo il trattamento.
2. Che cos'è il sequenziamento dell'intero esoma (WES) e che cos'è il WES specifico per il tumore?
Sequenziamento dell'intero esoma (WES):
a) Portata del sequenziamento: Comprende tutte le regioni codificanti dell'esoma umano (oltre 20.000 geni).
b) Profondità di sequenziamento: Profondità media effettiva di sequenziamento ≥100×; copertura di almeno il 95% a 20×.
c) Dati di sequenziamento: Volume effettivo di dati ≥10G.
SpaceGen ha sviluppato autonomamente una versione specifica per tumore del test Whole Exome Sequencing (WES). Oltre al WES standard, questo approccio include la copertura delle regioni di mutazione hotspot del tumore, delle regioni introniche relative alle fusioni geniche comuni, dei siti patogeni nelle regioni ClinVar non codificanti, dei marcatori SNP e delle regioni di instabilità dei microsatelliti (MSI). I risultati dei test sui campioni di base riguardano la terapia mirata, l'immunoterapia e la valutazione del rischio genetico.
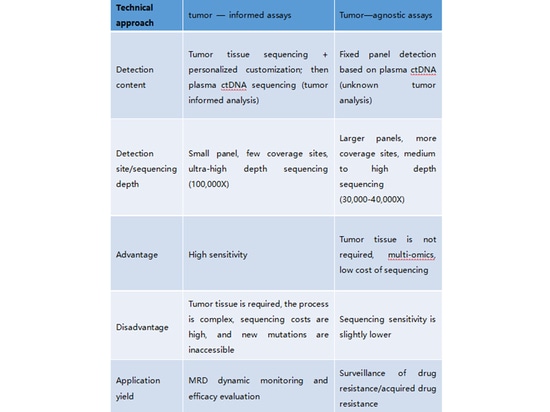
3.Che cos'è l'analisi informata sul tumore e che cos'è l'analisi diagnostica del tumore? Quali sono le loro caratteristiche?
L'analisi informata sul tumore (strategia informata sul tumore): l'analisi informata sul tumore, nota anche come strategia informata sul tumore, prevede l'analisi iniziale del campione di tessuto tumorale del paziente per comprendere specifiche variazioni genomiche. Successivamente, alcuni siti di varianti presenti nel tessuto tumorale vengono monitorati mediante analisi del ctDNA (DNA tumorale circolante). In questo approccio di monitoraggio della MRD, il principio "tumor-informed" si riflette in: (1) la selezione e la progettazione dei siti di monitoraggio del ctDNA in base alle mutazioni rilevate nel tessuto tumorale e (2) la determinazione dello stato MRD-negativo o MRD-positivo in base al rilevamento delle mutazioni derivate dal tumore nel ctDNA. Il prodotto Signatera di Natera esemplifica la strategia "tumor-informed". Inizia con l'analisi WES del tessuto tumorale del paziente per comprenderne il profilo di mutazione, seguita da un'analisi personalizzata del ctDNA mirata a 16 siti di variante specifici.
Analisi Tumor-Naïve (strategia Tumor-Naïve):
L'analisi tumor-naïve, nota anche come strategia tumor-naïve, non si basa sulla rilevazione di mutazioni dal tessuto tumorale del paziente. Si tratta invece di progettare un pannello specializzato per uno specifico tipo di cancro e di utilizzare l'analisi del ctDNA dal plasma del paziente. Questo approccio potrebbe anche incorporare altri metodi omici, come l'epigenetica, accanto all'analisi del ctDNA per determinare la MRD. Il prodotto MRD di Guardant Health è un esempio importante della strategia tumor-naïve. Oltre all'analisi delle mutazioni, questo prodotto integra l'analisi della metilazione per aumentare la sensibilità predittiva.
4. Quali sono i pannelli personalizzati e i pannelli fissi di MRD?
Per pannello personalizzato si intende un design di pannello che non prevede geni e loci fissi. Comporta l'esecuzione di pannelli di grandi dimensioni, il sequenziamento dell'intero esoma o il sequenziamento dell'intero genoma sul tessuto del paziente. In base a fattori quali la categoria, il tipo e l'abbondanza delle mutazioni geniche, viene selezionato un certo numero di geni personalizzati o su misura. Questi geni positivi selezionati servono come linea di base di riferimento per il successivo monitoraggio e confronto periodico.
Il pannello fisso, invece, è progettato in base alle caratteristiche molecolari di diversi tipi di cancro. In genere include geni driver e bersagli molecolari per terapie mirate per vari tipi di cancro. Un pannello fisso di geni/loci viene utilizzato per il sequenziamento ad alta profondità per eseguire un monitoraggio dinamico.
Sia i pannelli fissi che quelli personalizzati possono essere utilizzati in una combinazione incrociata per strategie Tumor-Informed e Tumor-Naïve. I pannelli fissi sono più comunemente applicati nei casi in cui non è possibile ottenere campioni di tessuto, come nel caso della strategia Tumor-Naïve.
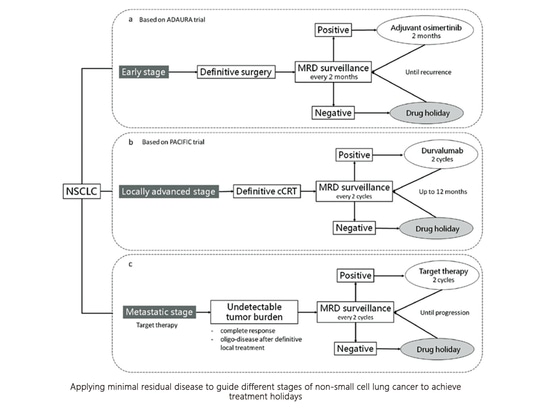
5. Qual è la vacanza del farmaco?
La vacanza farmacologica, nota anche come trattamento intermittente, si riferisce a una strategia in cui un farmaco viene temporaneamente sospeso dopo aver raggiunto un effetto terapeutico soddisfacente attraverso un uso prolungato. Nonostante l'interruzione del farmaco, l'efficacia del trattamento viene mantenuta. La durata della vacanza farmacologica può variare da alcuni giorni a mesi e persino anni. Sebbene il concetto di vacanza farmacologica non sia nuovo e sia stato utilizzato in altre patologie croniche che richiedono una terapia a lungo termine, la sua applicazione nel campo del trattamento del cancro richiede ancora ulteriori ricerche.
Un piccolo studio esplorativo condotto presso il Guangdong Provincial People's Hospital, riportato al WCLC 2021, faceva parte della sperimentazione CTONG 1602 (NCT03046316).
I criteri per la sospensione del farmaco includono:
1) Assenza di lesioni visibili alla diagnostica per immagini (TC, RM o PET/CT).
2) Malattia minima residua (MRD) negativa.
3) Antigene carcinoembrionale (CEA) negativo.
Durante la fase di sospensione del trattamento, i pazienti non ricevono alcun trattamento, ma sono sottoposti a monitoraggio mediante TC, CEA e valutazione della MRD ogni tre mesi.
Criteri per la ripresa del trattamento:
1) Progressione della malattia (RECIST PD).
2) MRD positiva.
3) Livelli di CEA in graduale aumento.
Applicazione clinica
1. Quali sono le differenze tra MRD e sequenziamento mirato al tumore?
Il sequenziamento mirato al tumore si concentra principalmente sull'identificazione di specifiche mutazioni genetiche in un tumore che sono rilevanti per le terapie mirate. Serve come strumento diagnostico o di guida per i trattamenti mirati e può anche essere utilizzato per studiare i meccanismi di resistenza alle terapie mirate. I pannelli di sequenziamento mirato spesso includono altri marcatori molecolari come l'instabilità dei microsatelliti (MSI), il carico mutazionale del tumore (TMB) e la valutazione della sensibilità alla chemioterapia.
La MRD, invece, mira a rilevare la malattia molecolare residua. Valuta la risposta al trattamento, monitora la recidiva e non è specifica per una particolare modalità di trattamento. Si concentra invece sul trattamento sistemico completo dei tumori maligni. La MRD utilizza pannelli personalizzati o fissi di variazioni del ctDNA per valutare dinamicamente la risposta al trattamento e l'insorgenza di ricadute e metastasi per ogni singolo paziente.
2. A quali tipi di cancro si applica attualmente la MRD?
In teoria, la MRD è applicabile a tutti i tumori solidi. Tuttavia, alcuni studi suggeriscono che i tumori del sistema nervoso centrale (SNC) potrebbero avere una sensibilità inferiore. Attualmente, sono stati pubblicati numerosi risultati di ricerca per tipi di tumore come il cancro del polmone, del colon-retto, della mammella, della prostata, dell'esofago, del fegato, della gola e della vescica.
3. Quali sono le applicazioni cliniche della MRD nella sua promozione?
Gestione completa perioperatoria:
a) Valutazione del beneficio della terapia neoadiuvante: analisi basale dei campioni bioptici + monitoraggio dinamico dei cicli di terapia neoadiuvante (più volte).
b) Rilevamento della malattia residua molecolare postoperatoria: Analisi basale del campione postoperatorio + valutazione della MRD (1 volta).
c) Valutazione del beneficio della terapia adiuvante (postoperatoria/progressione): analisi basale del campione postoperatorio/bioptico + valutazione della MRD (più volte).
d) Monitoraggio della ricaduta: Analisi basale della terapia postoperatoria/adiuvante + valutazione della MRD (più volte).
Come deve essere scelto il tempo di campionamento/monitoraggio della MRD?
Attualmente non esistono linee guida o documenti di consenso che forniscano raccomandazioni standardizzate sulla tempistica del campionamento basale e del monitoraggio della MRD. Tuttavia, il documento "Expert Consensus on Molecular Residual Disease in Non-Small Cell Lung Cancer" del 2021 descrive che l'emivita del ctDNA è di circa 35 minuti e lo stato del ctDNA tre giorni dopo l'intervento chirurgico può indicare il rischio di recidiva (studio DYNAMIC). La finestra iniziale per il test MRD è in genere fissata entro 4 mesi dopo il trattamento curativo, come indicato nel consenso. Per i pazienti con NSCLC localmente avanzato sottoposti a chemioradioterapia curativa e che si preparano all'immunoterapia di consolidamento, la finestra per il test MRD è definita almeno 1 settimana dopo la chemioradioterapia curativa (studio CAPP-Seq).
Attualmente, il consenso raccomanda che la finestra temporale iniziale per il test MRD per il NSCLC sia compresa tra 1 settimana e 1 mese dopo il trattamento curativo.
4.La MRD con strategia Tumor-informed può essere utilizzata su pazienti senza campioni di tessuto o trattamento?
Il monitoraggio della MRD con la strategia Tumor-informed richiede il sequenziamento del tessuto tumorale e la personalizzazione del pannello di rilevamento della MRD in base alle informazioni di variazione personalizzate del paziente. Il limite di questa strategia è la dipendenza dal tessuto, quindi la MRD con la strategia Tumor-informed non può essere utilizzata senza campioni di tessuto.
Pazienti trattati: I tumori hanno un'eterogeneità spaziale e temporale. Le opzioni di trattamento per i diversi tipi di cancro possono modificare le caratteristiche molecolari dei tumori. Esistono differenze tra l'analisi di base dei campioni tumorali precedenti e le caratteristiche molecolari dopo il trattamento, che possono influenzare l'accuratezza dei risultati del test. Attualmente non esiste un parere unificato nelle linee guida e nel consenso. Le lesioni ricorrenti/metastatiche possono essere utilizzate per l'analisi basale, per il follow-up di sorveglianza dinamica o per la strategia Tumor-naïve.
6. Se la prima malattia minima residua (MRD) postoperatoria è negativa e viene somministrato un trattamento adiuvante clinico postoperatorio, è ancora necessario condurre un monitoraggio dinamico multiplo di follow-up?
Un risultato negativo della MRD non significa che il paziente sia esente dal rischio di recidiva o metastasi. Lo stato residuo molecolare negativo postoperatorio non è l'unico criterio per valutare l'idoneità del trattamento adiuvante nella valutazione clinica. Anche se il test MRD iniziale è negativo, è comunque consigliabile monitorare dinamicamente la situazione delle recidive e delle metastasi nei follow-up successivi e procedere al monitoraggio e alla diagnosi in base alle raccomandazioni dei medici clinici.
SpazioGen
SpaceGen ha introdotto servizi di rilevamento della malattia molecolare residua (MRD) dei tumori solidi con un ampio pannello di test che supporta vari rilevamenti della MRD dei tumori solidi per soddisfare le esigenze cliniche.
1. Qual è l'approccio tecnico per i servizi di rilevamento della malattia molecolare residua dei tumori solidi (MRD)?
Il rilevamento della MRD di SpaceGen impiega una strategia di analisi a pannello personalizzata, nota anche come Tumor-informed assays. Si inizia con l'esecuzione di un sequenziamento completo dell'intero esoma (WES) sul tessuto tumorale primario per identificare le mutazioni genetiche specifiche del paziente. Successivamente, viene progettato un pannello personalizzato per individuare un numero specifico di siti di mutazione nel tessuto da analizzare successivamente con il ctDNA (DNA tumorale circolante).
Test WES focalizzato sul tumore (tessuto tumorale + sangue periferico) → Selezione di siti di mutazione specifici → Personalizzazione del pannello → Monitoraggio multiplo in corso (campioni di sangue periferico)
2. Vantaggi e parametri del progetto
- Sviluppo indipendente del rilevamento dell'intero sequenziamento dell'esoma (WES) incentrato sul tumore, che va oltre il WES standard includendo la copertura delle regioni di mutazione hotspot del tumore, delle regioni introniche rilevanti per le fusioni geniche comuni, dei siti patogeni nelle regioni ClinVar non codificanti, degli scaffold SNP (Single Nucleotide Polymorphism) e delle regioni MSI (Microsatellite Instability). I risultati del rilevamento dei campioni di base riguardano la terapia mirata, la terapia immunitaria e la valutazione del rischio genetico.
- I pannelli personalizzati su misura utilizzano l'amplificazione a singolo primer sviluppata internamente e la tecnologia di costruzione di librerie di sequenziamento UMI (Unique Molecular Identifier).
- La selezione automatica del sito di monitoraggio viene effettuata utilizzando un punteggio ponderato basato su fattori quali la frequenza di mutazione, la funzione del gene, il tipo di mutazione e il livello di mutazione. Questo approccio aumenta la sensibilità nella selezione dei siti per il monitoraggio.
- Il sequenziamento ultra-profondo (100.000X) combinato con l'analisi UMI raggiunge una sensibilità di rilevamento delle mutazioni dello 0,05%, soddisfacendo i requisiti per le prestazioni di rilevamento della MRD.
- L'analisi di base e il monitoraggio dinamico multiplo consentono una diagnosi e un trattamento completi del tumore, offrendo un ciclo completo di monitoraggio dinamico della MRD nel corso del trattamento del cancro.
3. Opzioni di combinazione
Gestione completa e flessibile con scelte multiple:
- Analisi basale dell'intero esoma + 1 ciclo di monitoraggio dinamico
- Analisi dell'intero esoma al basale + 3 cicli di monitoraggio dinamico
- Analisi dell'intero esoma al basale + 6 cicli di monitoraggio dinamico
- Analisi dell'intero esoma al basale + N cicli di monitoraggio dinamico
Applicabile per la previsione della prognosi, la valutazione del rischio di recidiva e il monitoraggio dell'efficacia del trattamento in vari tumori solidi.